
Technical Data
技术资料
质谱实验的QC方法包括:样品准备、液相色谱、质谱采集以及谱图质量等。前两期关于质谱污染物的防控,大部分是属于样品准备阶段的质控工作。关于液相、质谱仪器的使用中的质控,由于各类质谱的调试维护方法各不相同,本专题不涉及这些内容,而我们给出一个统一的QC方式,帮助您快速进行数据质量把控,可以采用Quic软件评判LCMS表现的好坏。
色谱质谱系统的稳定性及表现评估:Quic
Quic是Biognosys公司推出的一款免费的质控软件(下载和序列号请联系我们获取),对质谱运行结果的表现进行可视化。它支持连接线性或者非线性梯度反相色谱的不同质谱仪器厂商(目前支持ThermoFisher和Sciex)产生的DDA、DIA、MRM和PRM数据类型。在使用Quic软件进行质谱数据质控时,我们其中需要用到IRT标肽试剂盒辅助,成本<20rmb/sample。只需要在上质谱前加入IRT标肽,即可实现对色谱质谱系统的运行表现评估。IRT的概念请参考http://www.omicsolution.com/index.php/Information/detail/id/17.html 。
在具体实验中,在每一个样品中加入Biognosys的质控试剂iRT Kit(根据多肽在色谱中的保留时间校准,用于MRM、PRM、DIA和DDA数据)。对于DDA和DIA,额外添加了一个预定义的谱图库作为目标,可以进一步进行蛋白鉴定效果的QC分析。默认的背景数据库包含Human(Hela)多肽,常见物种的背景数据库可以向我们咨询获取。我们在这里简要来说明Quic的设置以及使用方法,具体可以查阅Biognosys官方提供的manual。
1.设置
在第一次使用时,推荐采用Quic的默认设置以获得最佳效果。
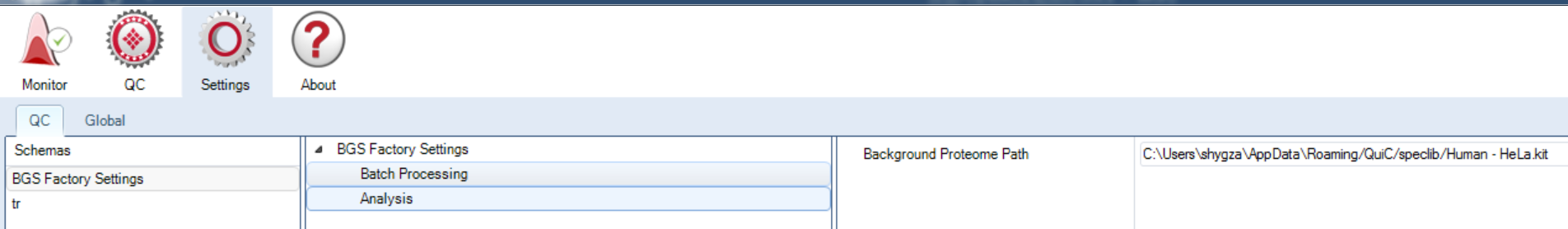
Settings界面下首先analysis选项的background proteome path在分析非人类样品的时候可以选择已有的当前物种spectral library进行鉴定效果评估。其余可以不用修改。如果您目前没有针对性的spectral library那就不用修改该选项,但DDA结果评估模块就不具备参考意义了。
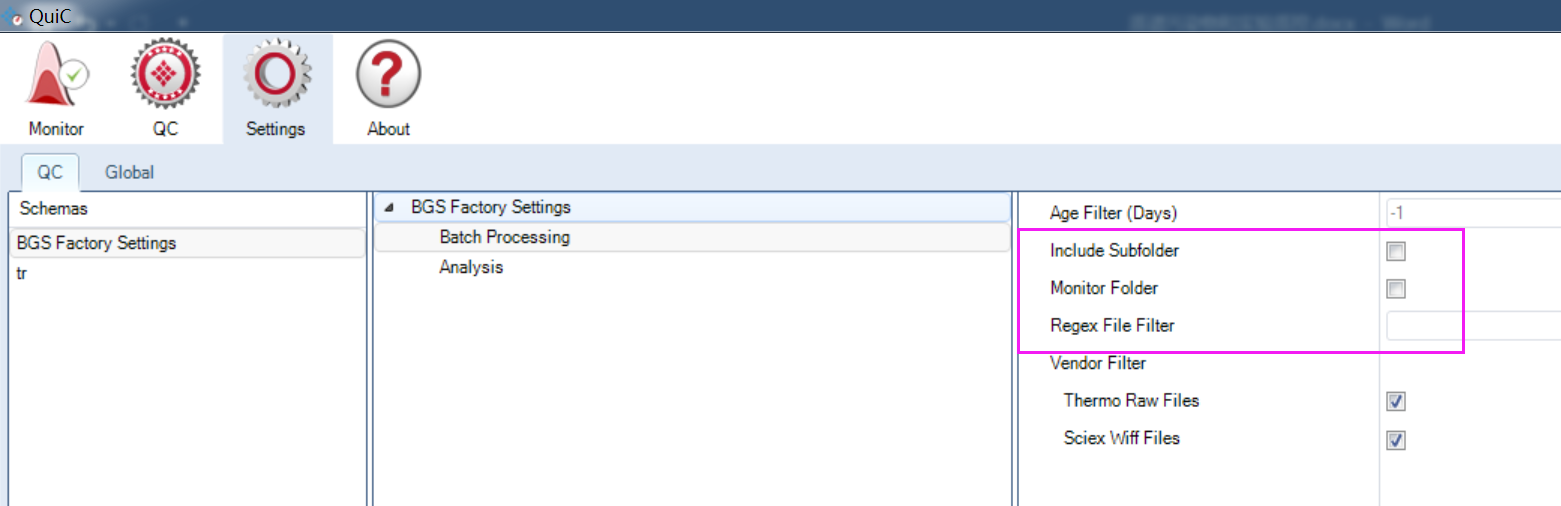
Batch processing面板下 include subfolder、Monitor folder设置选中后可以让Quic软件自动监控您质谱采集数据所存放的目录,那么每当质谱产生一个新的原始数据,Quic就会自动进行质控并报告。
2. 使用
Quic可以通过实时监控质谱产生数据的文件夹来执行QC分析,另外,文件也可以被添加用于QC分析。
Monitor界面:允许管理来自Thermo和Sciex的DDA、DIA、MRM和PRM不同文件的QC分析。在这里可以设置QC运行的任务列队,在运行被处理时,提取元数据和可视化可以在传输过程中在QC界面获取。
QC界面:Quic存储所有的QC分析必要的信息和提供提取值的概览。数据概览的这一步是用以运行为基础的可视化来完成的。
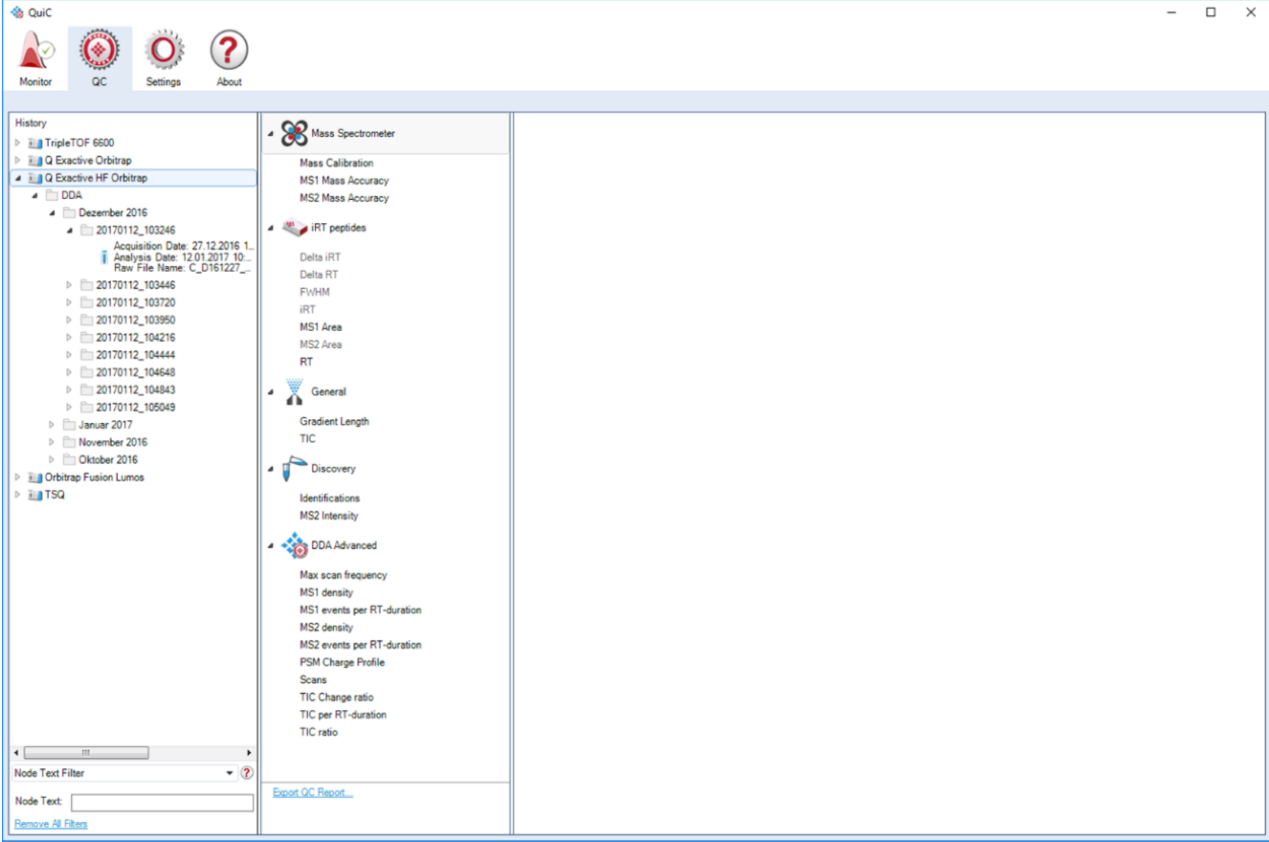
在history的树状图下,数据来源于哪一个质谱仪作为运行历史层次的主节点,每一个仪器可以展开来显示所使用的不同的工作流程。
Quic提供被选中的不同的QC过程的直方图或者箱线图来比较它们的分布。在某些情况下,可以选择两个绘图类型,并将它们通过坐标轴来比较离散的点(例如,在history tree中选择一个单独的run,并单击控件 “iRT”和“RT”来查看散点图比较)。下图展示了在选择多个run 的情况下,通过单独的箱线图来表示的每一个run的二级质谱的精度,注意这图始终确保这些run按采集数据的时间先后来排列,以便更好地跟踪仪器的性能随着时间的推移的变化。
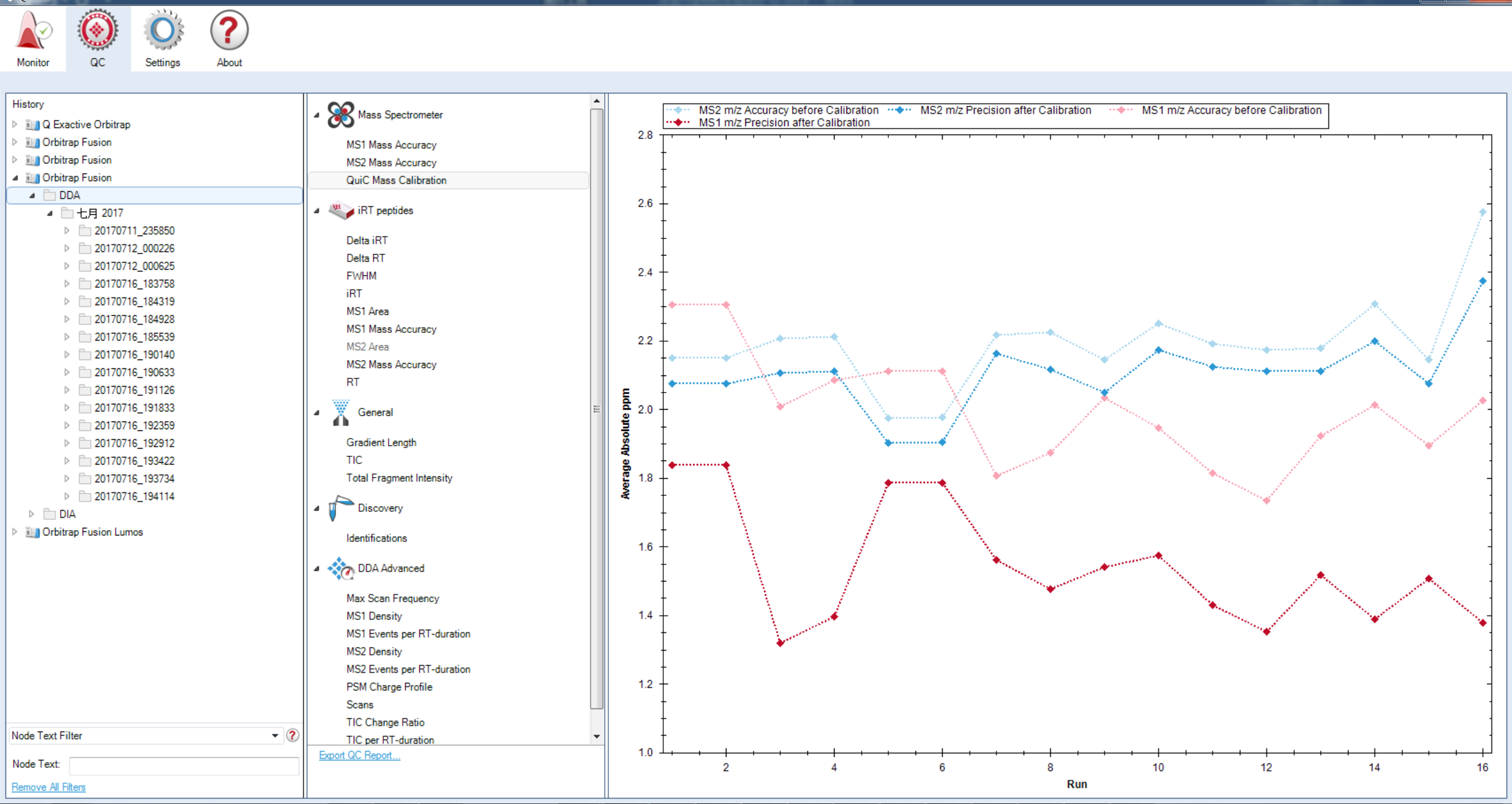
Mass spectrometer:仪器的QC在这部分显示在背景谱图库中所有的多肽。
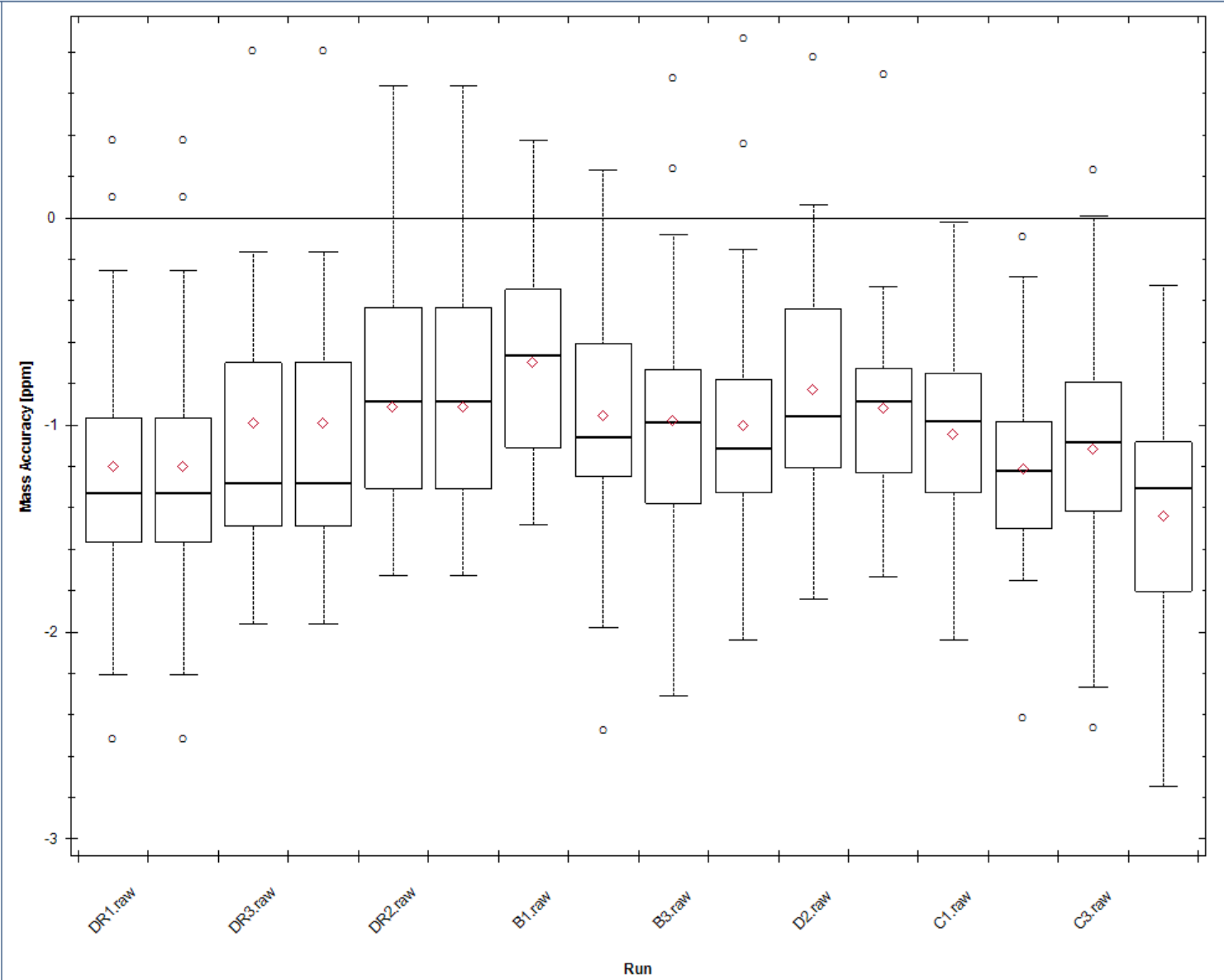
Quic Mass Calibration:MS1和MS2在QuiC校正前的绝对质量精度(ppm)与校正后的精度。其平均值通过背景谱图库中的已鉴定的肽来计算。
MS1 (MS2) Mass Accuracy:未经校正的质量误差在Mass calibration图上取平均。本模块可以帮助您监控质谱精度稳定性,一般来说高精度质谱在长期运行时的质量精度需要在-5~5ppm以内以保证结果的准确性和可重复性。
iRT Peptides: 此类别中的图表只显示从iRT试剂中被鉴定的肽中提取的QC数据.
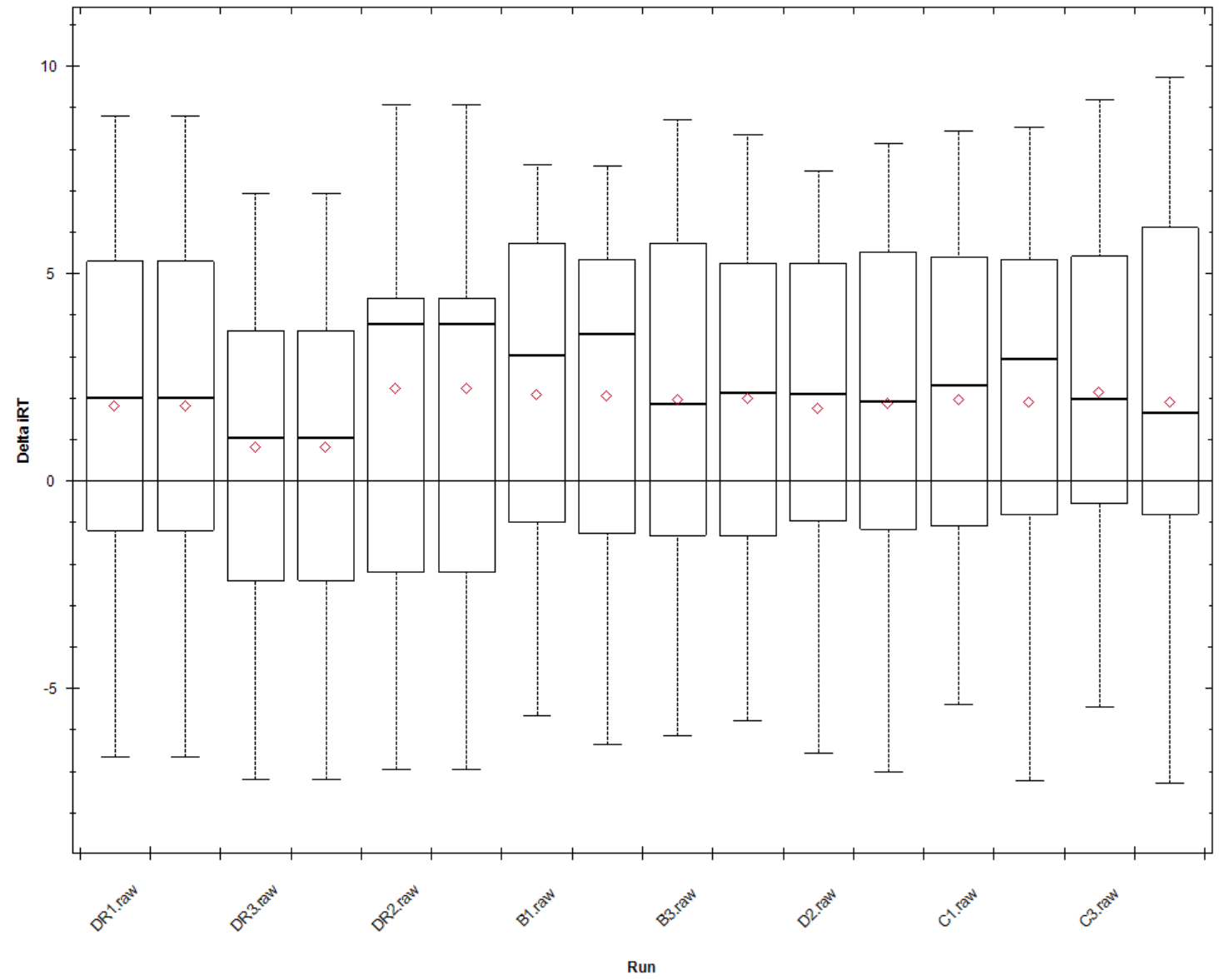
Delta iRT:本次实验中检测到的iRT与预测iRT间的差异,预测的iRT值是每个iRT标肽所独有的数值属性,而检测到的iRT值来自于RT/iRT回归计算。
Delta RT:本次实验中检测到的RT与预测RT间的差异,预测的RT值来自于iRT/RT回归,而检测到的RT值来自于本次LCMS检测中的峰顶的RT值。
相关概念详细阐述请参考: http://onlinelibrary.wiley.com/doi/10.1002/pmic.201500488/full
对我们快速质控来说,所有run间的Delta曲线尽可能接近0且一致则越理想。如下图:
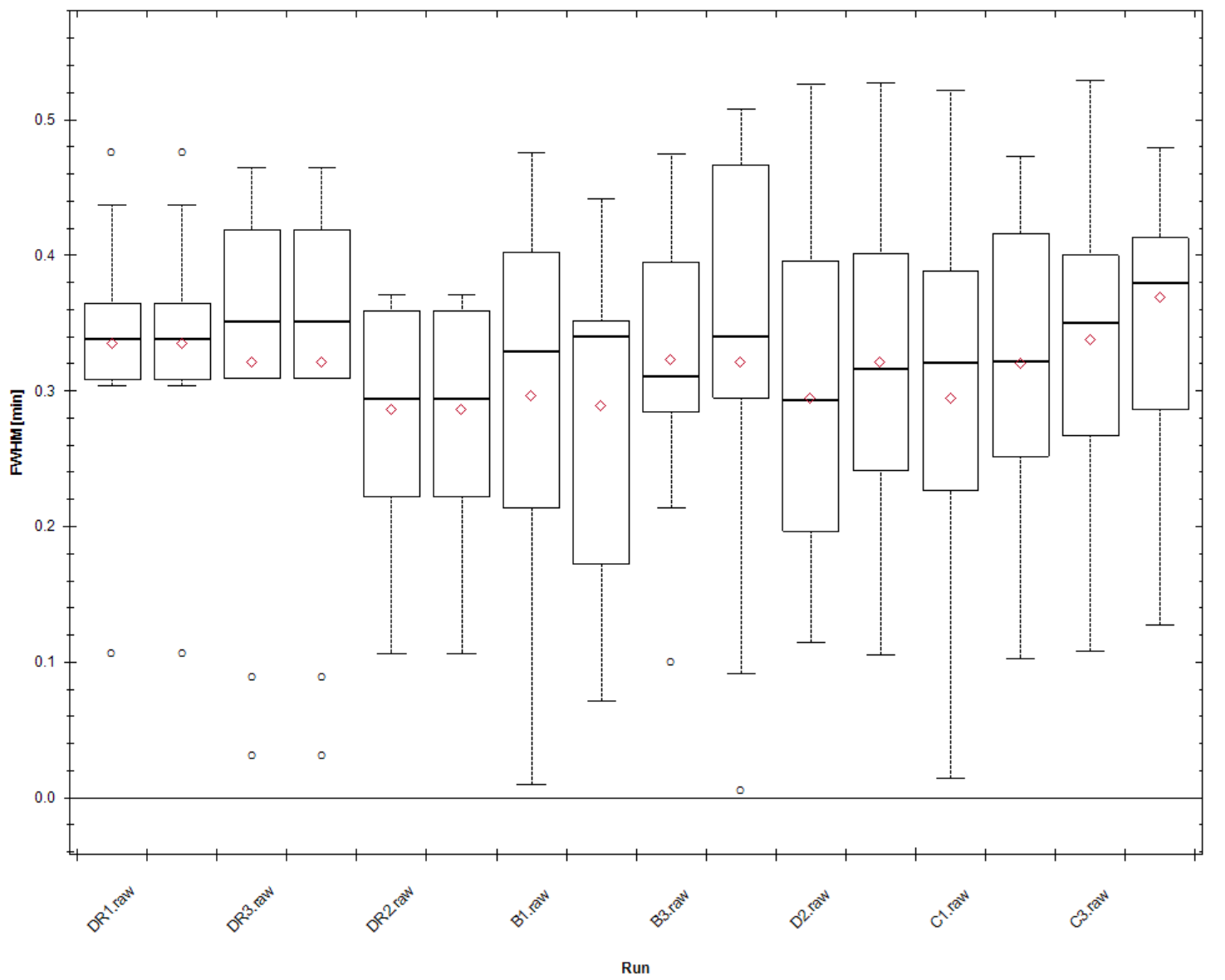
FWHM:MS2离子流出峰半高时的完整峰宽,该分布可以提现色谱柱对肽段的分离能力及拖尾严重程度,该值理想情况下再0.3~0.4之间能够实现较好的分离检测。
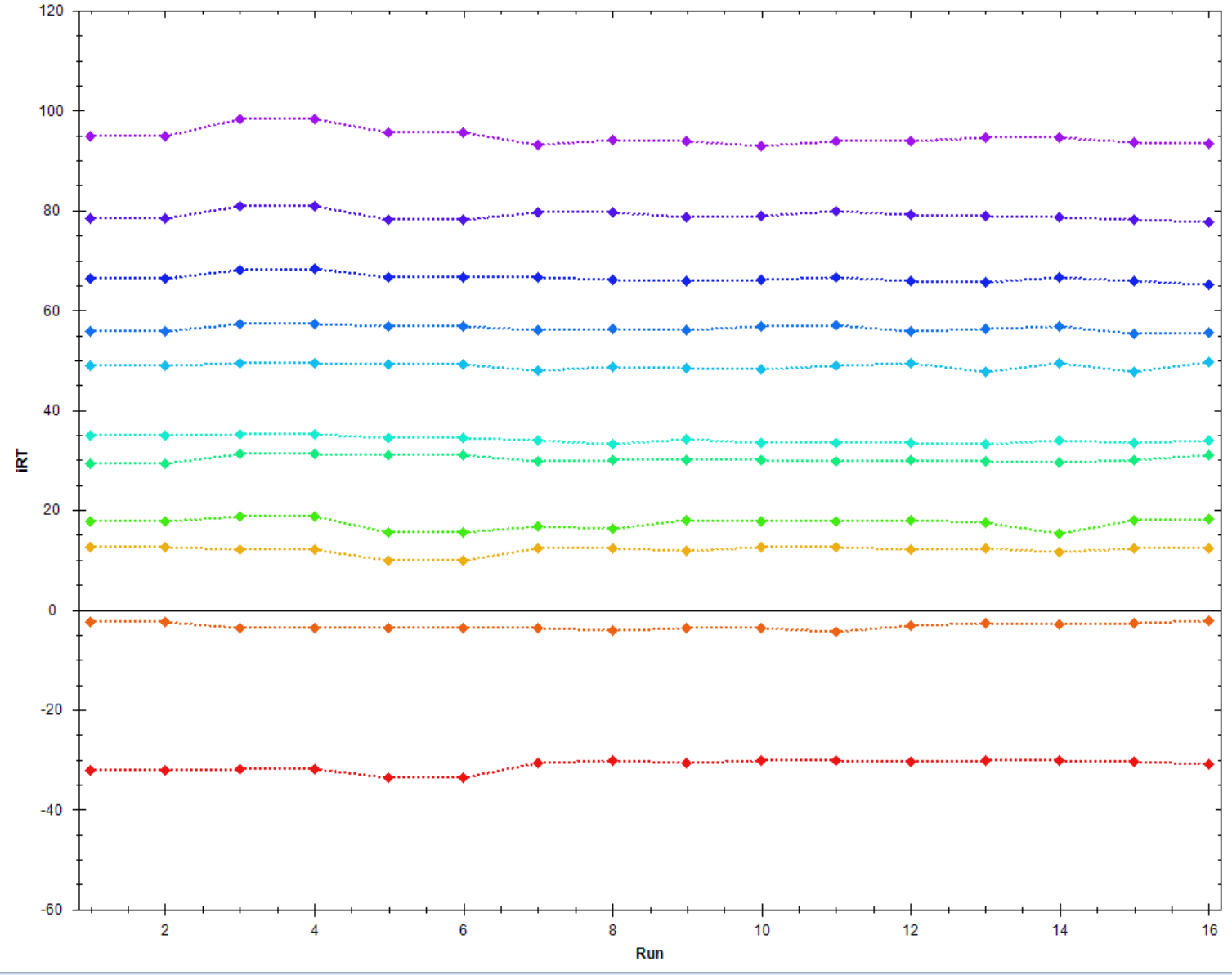
IRT:检测到的标肽母离子iRT分布,理想情况下11条iRT肽段都应该能够检出,并且第二条(橙色)iRT肽的数值应该接近0,而第11条(紫色)iRT肽的数值应该接近100。如下图
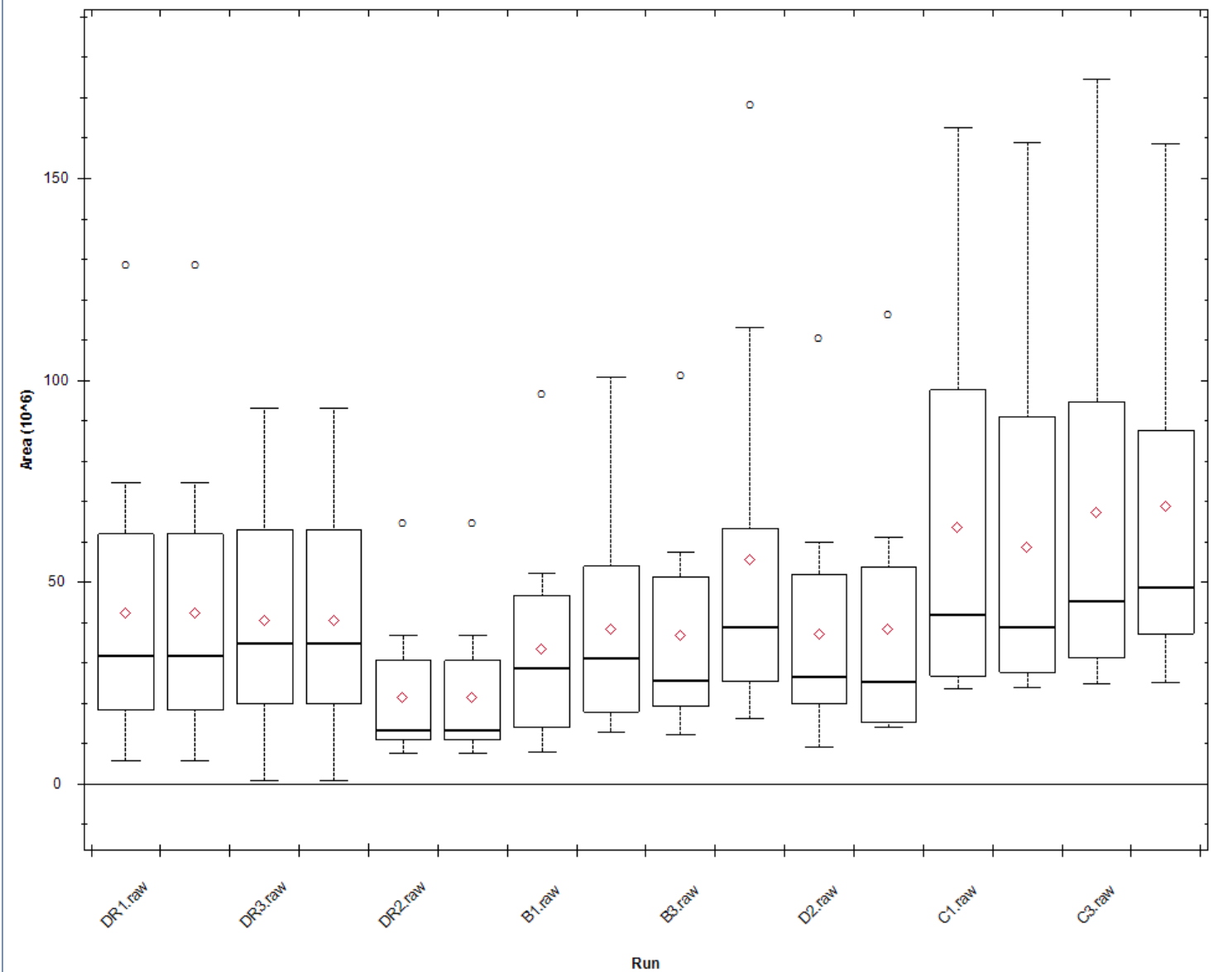
MS1 Area: iRT肽段母离子峰面积分布,并无特别指标性意义,iRT矫正不要求每次上样量完全一致。如果有部分run MS1特别低,则表明质谱灵敏度或者iRT肽上样量有问题。
MS1 Mass Accuracy:母离子的iRT肽段质核比精确度,该值可以评估质谱一级检测精确度。尽可能分布在-5~5ppm内。
MS2 Area:
MS2 Mass Accuracy: MS2的Area和accuracy对应于二级离子信号,也一样要求足够准确和强度一致。
RT: iRT肽段实际检测到的保留时间,也同样希望每次结果能够检测到所有11个iRT肽且保留时间在整个色谱时间一样的情况下尽可能一致。
General:
Gradient Length: 梯度长度,无指标性意义,仅作为展示用。
TIC: 将选择的所有run的TIC图合并展示,无指标性意义。
Total Fragment Intensity: 每个MS2的总离子强度分布,其绝对值因为不同的系统而不同,尽可能和已知结果优秀的数据对比从而可以判断其强度是否优秀。
Discovery:
Identifications:每个样品以background spectral library进行检测后大约鉴定到的MS2数量,作为鉴定效果评估用。很多实验室经常用hela细胞进行质谱状态检测的标准样品,但是往往只看鉴定到的蛋白数量,并不是非常全面合理,我们可以在hela细胞酶解液中加入iRT多肽,使用hela细胞谱图库在Quic中就能同时对定性、定量、色谱质谱表现进行一站式全面评估。
DDA Advanced: 以下指标只在DDA采集模式下有效
Max Scan Frequency: 每一分钟MS1或MS2采集的最高速度。无指标性意义。
MS1 Density: 每段RT时间中MS1的数量分布
MS1 Events per RT-duration: 将所有MS1扫描分为等分位数后每一部分所在的RT时间段。
MS2 Density:
MS2 Events per RT-duration: 以上两参数和MS1类似。
PSM Charge Profile: 不同电荷数的PSM数量分布
Scans: 采集到的MS1(2)的数量
TIC Change ratio:总离子强度变化率,展示每个等分位数中的TIC强度比前一个等分位数的TIC强度增加/减少的倍数。
TIC per RT-duration: 每段RT等分时间中TIC的累积强度。
TIC Ratio: 每段RT等分时间的TIC强度除以前一段等分时间的TIC强度比值。
以上指标均无绝对参考标准,但可以比较大量平行或相似样品以评估长时间运行下的质谱表现和稳定性。
