
Technical Data
技术资料
众所周知,半胱氨酸在维持蛋白质的高级结构时起着十分重要的作用:空间位置上比较接近的两个半胱氨酸残基可以通过二硫键的形成来维持该蛋白的稳定性。对于单克隆抗体来讲,这种作用就更加显而易见:两条重链和两条轻链通过链间二硫键组装成为完整的抗体。下图所示即为常见的几种IgG抗体的二硫键结构示意图。

可以这么说,半胱氨酸残基在组成蛋白质的诸多氨基酸残基中算得上是让研究者们又爱又恨的一种氨基酸了。为什么这么说呢?因为半胱氨酸的侧链巯基反应活性高,如果研究者们想要在蛋白质的多肽链上做文章的话,巯基或者氨基往往是他们的首选反应基团。但也正因为巯基反应活性高,一旦半胱氨酸不是目标反应物,那么自由巯基的存在则很可能引入不必要的副产物。正常情况下,无论是人体自身产生的IgG抗体还是生产上的治疗性单抗,序列中的成对半胱氨酸会以链内或者链间二硫键的形式存在以维持其蛋白结构和稳定性。然而,总会有那么一小部分“变异者”逃脱了“追杀”,或形成错配的二硫键(disulfide scrambling)、三硫键(trisulfide)、或发生“异变”:半胱胺酰化(cysteinylation)、谷胱甘肽化(glutathionylation)、硫醚化(thioether)等。我们将以几个典型案例来讲讲采用质谱技术如何一步步追踪这些“变异者”,希望能够给生物制药的同行们带来一点点思路。今天的这个case是讲如何发现并确证半胱氨酸的半胱氨酰化修饰的。
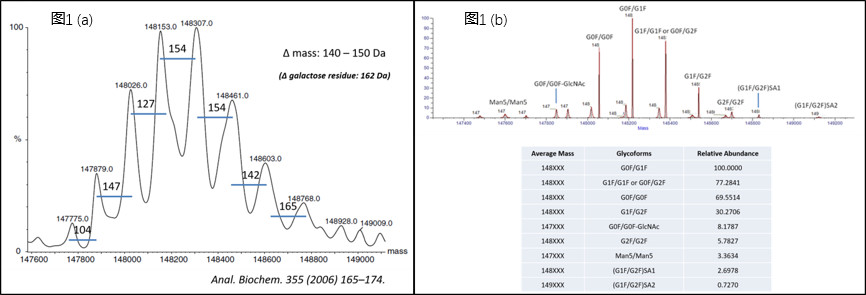
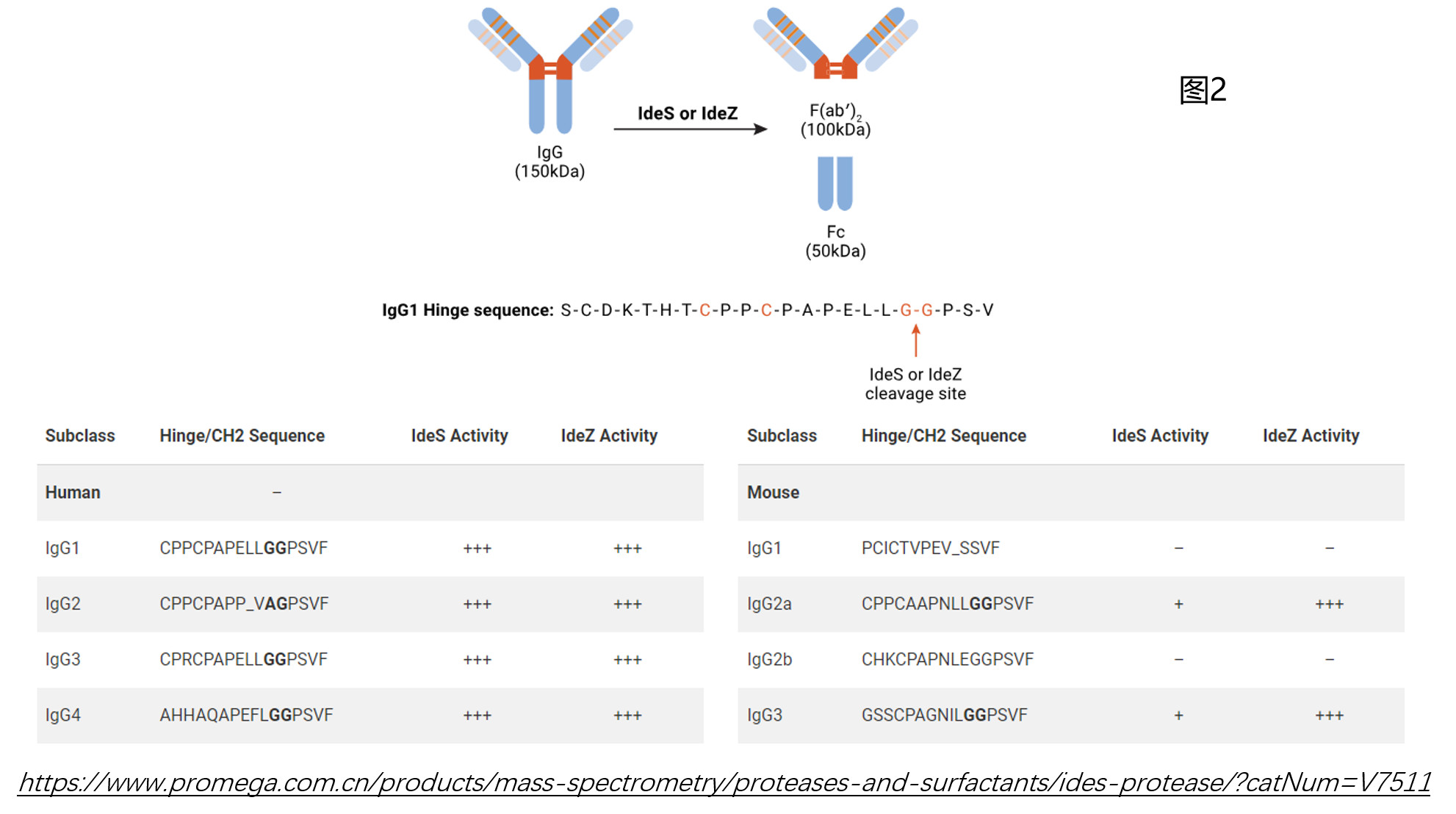
Amgen公司的Himanshu S. Gadgil等人在进行完整抗体分子量检测时发现去卷积质谱图中出现多个质量差异在140-150 Da峰(Anal. Biochem. 355 (2006) 165–174. 如图1a所示),不同于常见的由于糖型的存在而引起的162 Da的差异(如图1b所示),怀疑这是由于某种修饰和糖基化修饰叠加效果所产生的。为了追溯其缘由,比较理想的办法是将大的抗体(150 kD)分解成小一点的亚结构片段,这样既能更好的定位修饰发生的区域,又能知晓更加精确的质量差异(目标蛋白分子量越小,同样分辨率设置下得到的质量精确度越高)。有很多酶可以实现这一目标,例如木瓜蛋白酶(papain)或是IdeS/IdeZ。相对来说,papain的特异性不那么高,不过根据文献报道和我们的实际操作经验,可以通过控制酶解的时间,使得得到的亚结构片段不会那么碎(对于IgG1亚型的抗体,papain的酶切是分步进行的:首先,papain会将位于重链铰链区链间二硫键N端附近的第224和225位的组氨酸H和苏氨酸T切开;然后,会切开重链第233位和234位的谷氨酸E和亮氨酸L;第二步的酶切位点与第一步的酶切位点相隔9个氨基酸,更靠近铰链区链间二硫键的C端。如果不控制反应时间,papain则会紧接着不停的往下切,直到切成很多小肽段。——Immunochemistry 14(3):197-200.)。总体来讲,这是较为廉价、容易获取的一种酶。另一种我们常常提到的则是IdeS/IdeZ,它们具有高度特异性,但相对而言价格昂贵。IdeS/IdeZ能够快速高效的特异性切割铰链区下方的单个位点,获得高纯度的亚结构片段(如图2所示)。当然,对于不同种属不同亚型的IgG抗体,IdeS和IdeZ的酶切反应活性也还是略有差别的(具体参考图2中表格内容)。
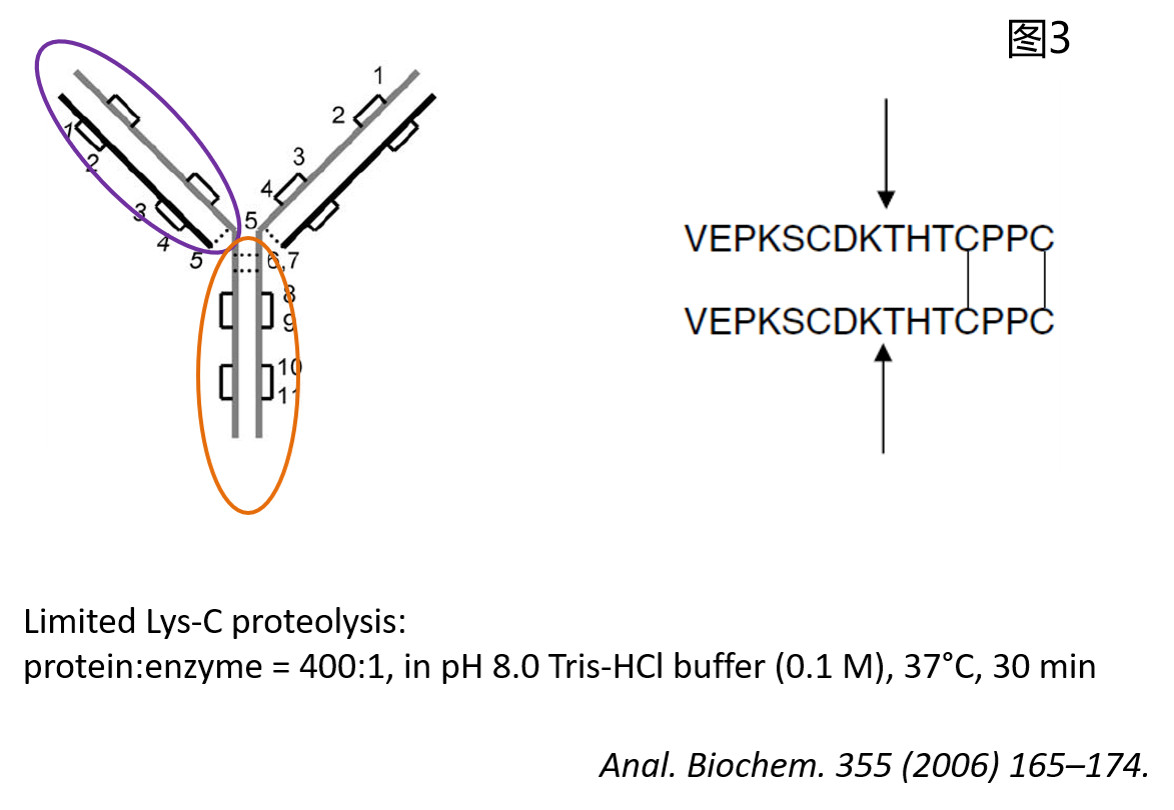
然而,Himanshu S. Gadgil等人则采取了另一种策略——采用限制性Lys-C酶切的方法(protein:enzyme = 400:1, in pH 8.0 Tris-HCl buffer (0.1 M), 37°C, 30 min),通过控制反应条件,将IgG1仅从重链的铰链区上方切断,从而得到Fab和Fc片段(如图3所示)。当用反相液相色谱进行分离时,会得到两组Fc和Fab片段的峰(如图4所示)。
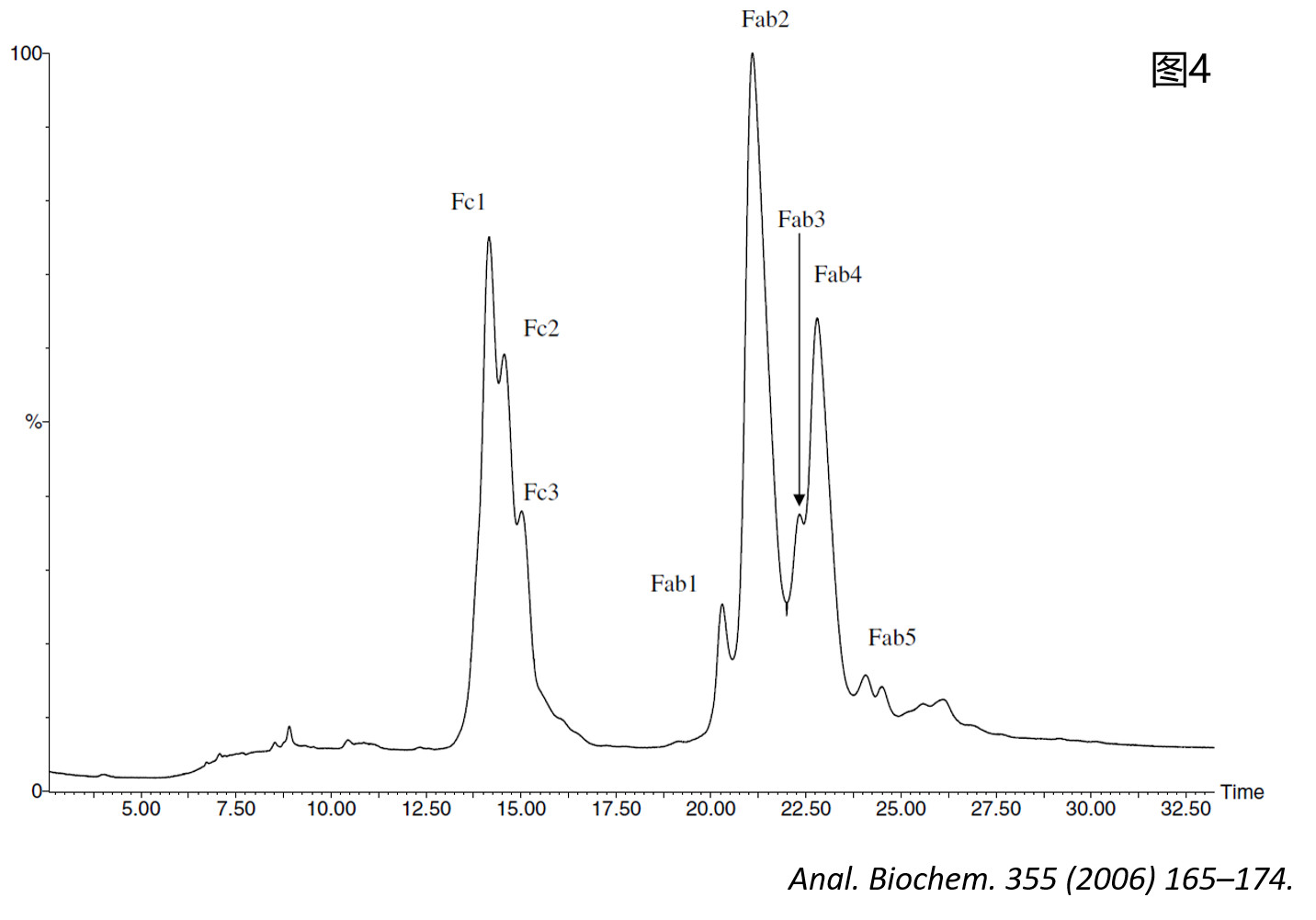
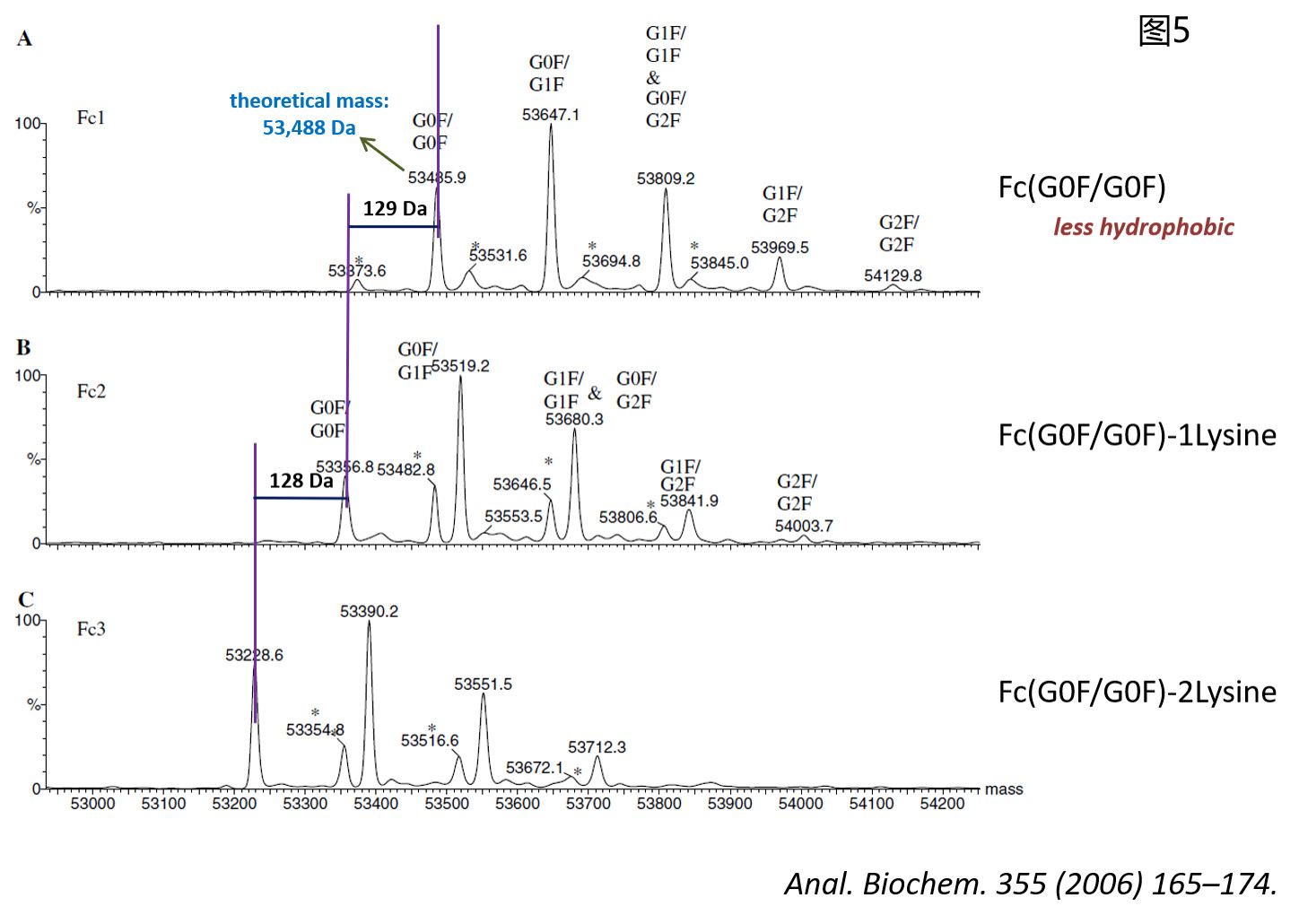
这时候再对每种片段进行精确质量分析,即可从整体蛋白层面获取关于PTM的信息。如图5所示,Fc1组分中53485 Da的峰即对应于限制性Lys-C酶切后理论分子量为53488 Da的Fc片段G0F/G0F糖型结构,而在Fc2和Fc3组分中对应于该糖型结构的则为分别失去一个C端赖氨酸(Lysine, K)的成分(质量差值为128 Da,均在图5中用紫色竖线标注)。
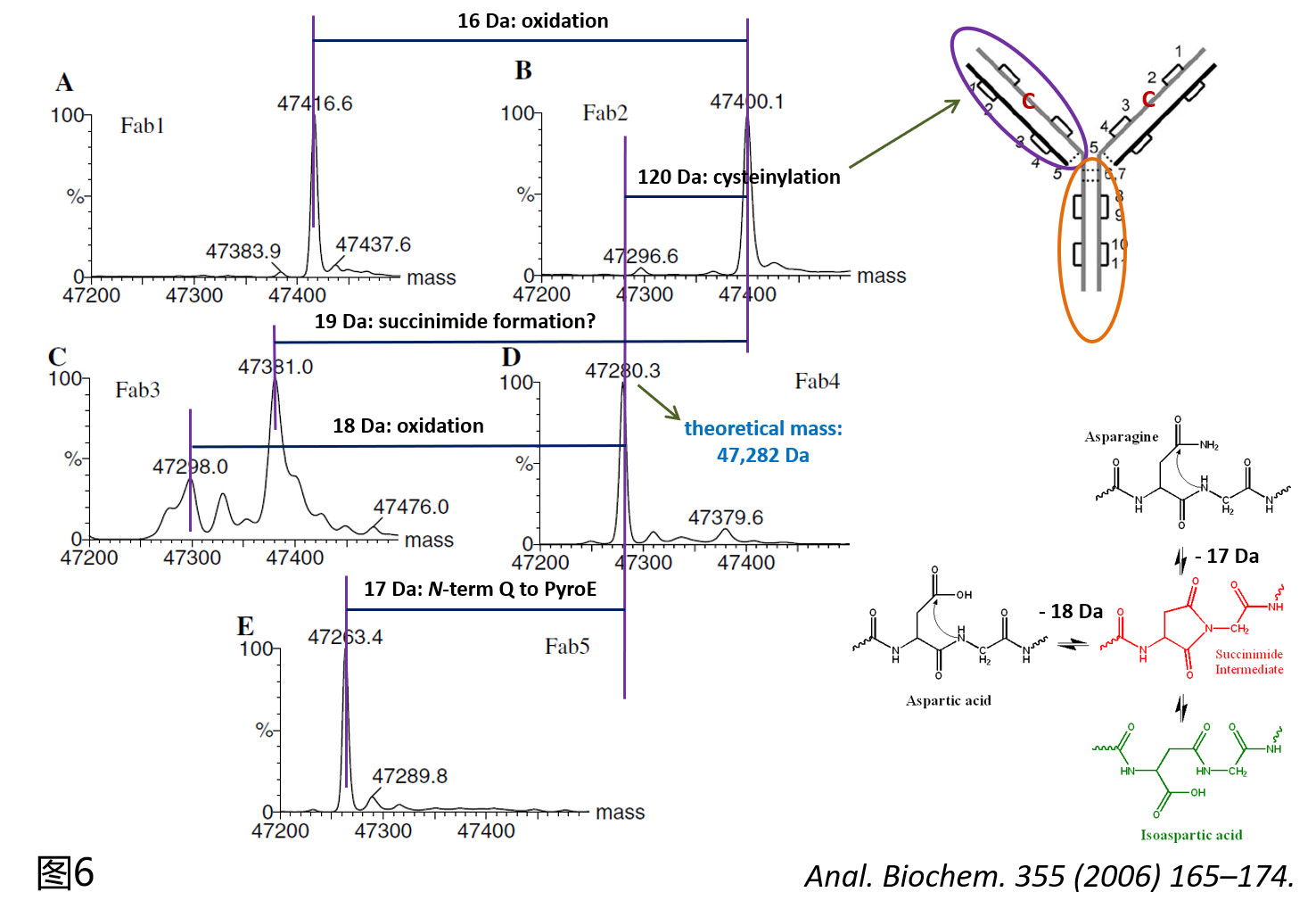
而当把限制性酶切得到的Fab各组分进行精确分子量分析时(图6),可以发现,Fab4组分中的主峰为即为匹配理论分子量为47282 Da的Fab成分,再分别计算Fab1,2,3,5中主峰跟其的差值,作者推测在Fab2中出现的与Fab理论分子量相差118 Da的成分可能是在该抗体HC第104位的未成键半胱氨酸上发生了半胱氨酰化修饰(Cysteinylation,Δmass=119 Da;这个质量差值所对应的蛋白质翻译后修饰种类其实是很少的,这也是作者做出推断的理由之一)。
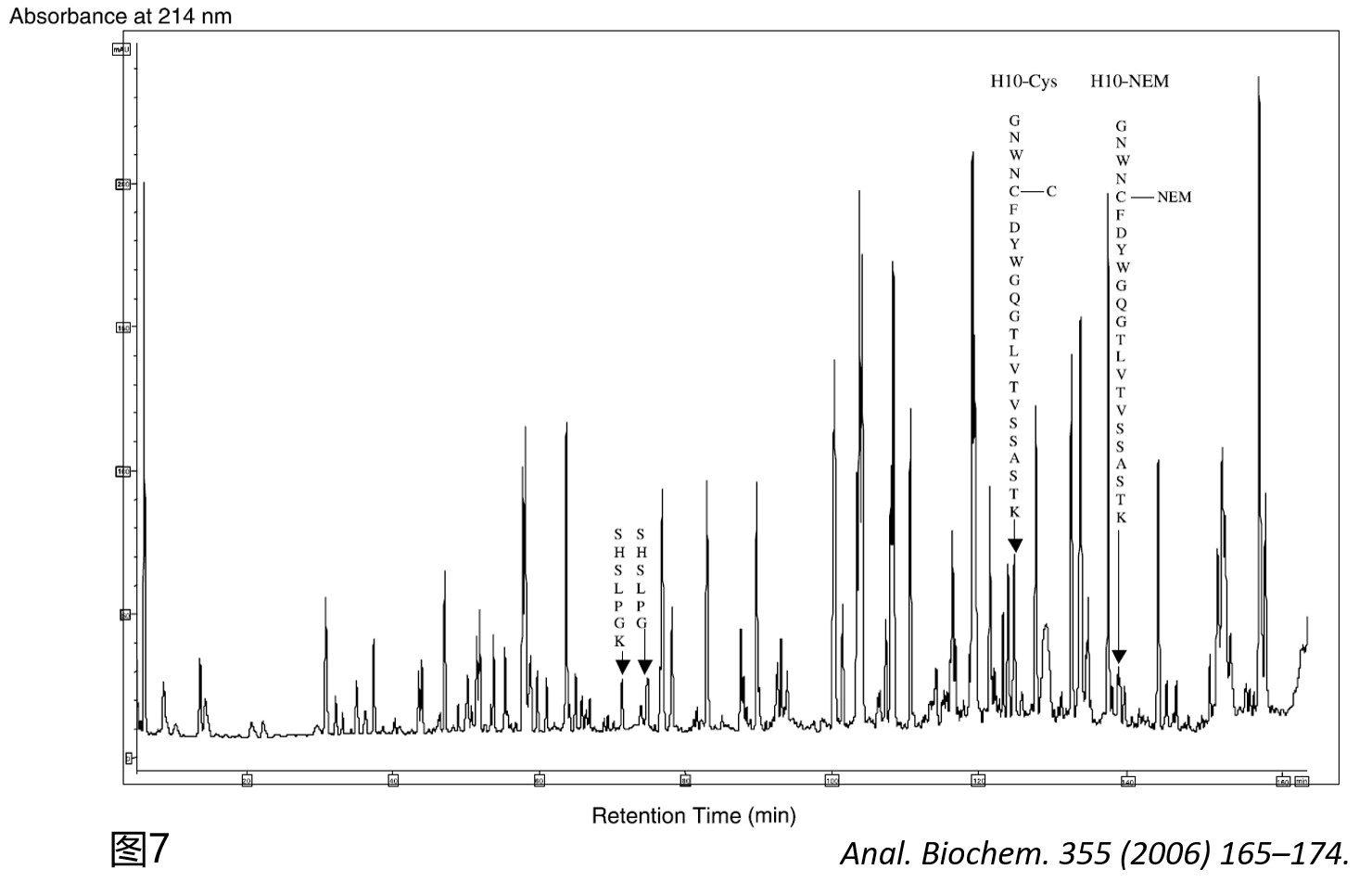
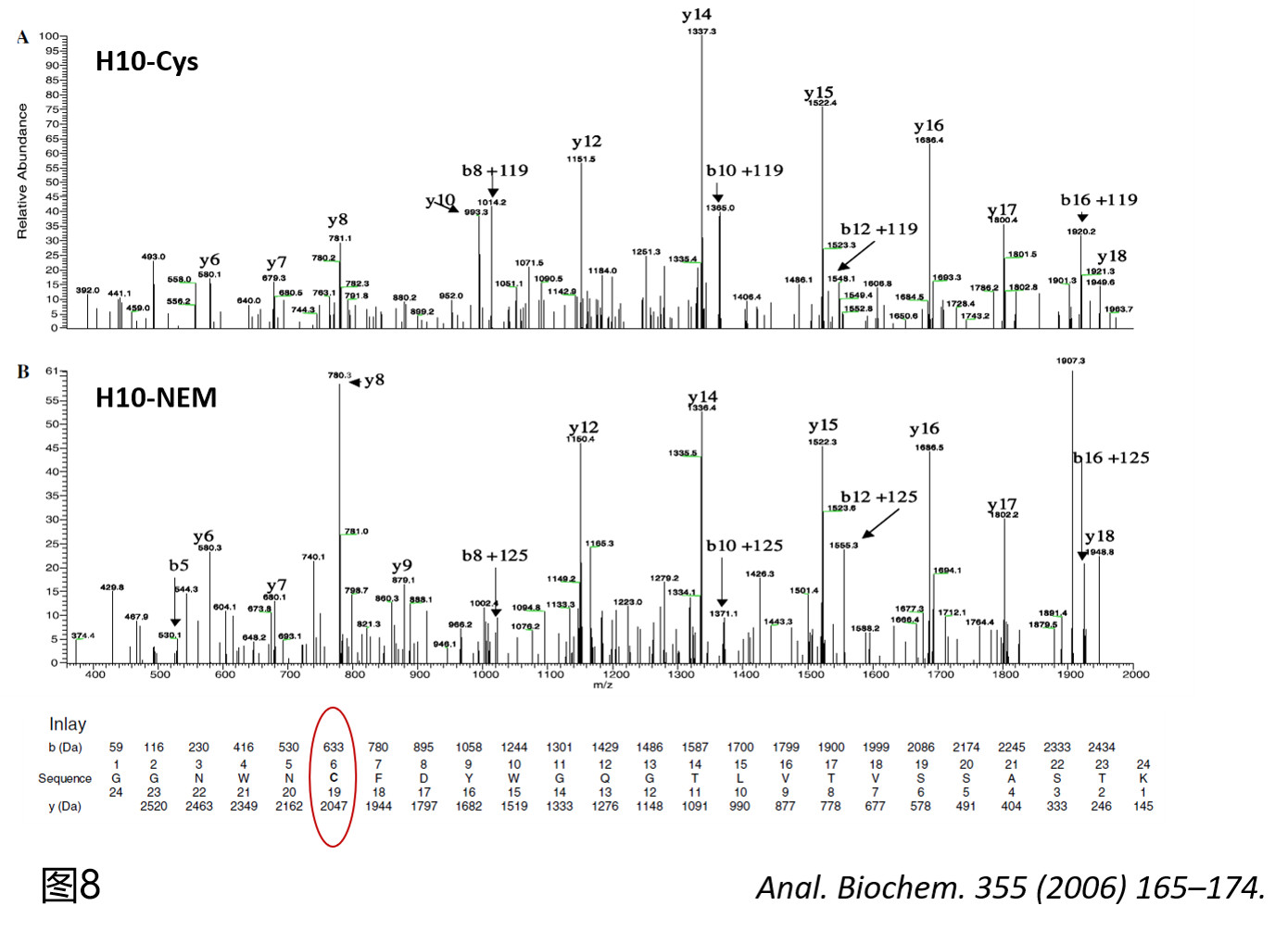
为了进一步验证这个推测的正确性,作者对该抗体在不进行DTT还原的条件下采用NEM封闭所有的自由巯基,继而用胰酶酶解后进行肽谱分析,在肽图上找到了流出时间为127 min和142 min的两条肽段,一级分子量匹配显示其分别对应于氨基酸序列为GGNWNCFDYWGQGTLVTVSSASTK(含前述所说的未成键C104)肽段发生半胱氨酰化修饰或经NEM封闭后的组分分子量(图7),其二级谱图则精确指认了半胱氨酰化和NEM发生的精确位点即为C104(图8)。
其实各大主流厂商的质谱软硬件发展到了今天,不论是在质量精度、分辨率,还是在数据解析方面,都有了极大的进展。对于这一类简单的单抗蛋白翻译后修饰的鉴定,早已不再是难题。推这篇文献的原因是因为这是比较经典的单抗蛋白药物质谱分析的套路——从蛋白层面的发现,再到亚结构片段的大致定位,最后到肽段层面修饰位点的确认,层层深入,环环相扣,而且作者所使用的Lys-C酶相对廉价,有效控制了试剂耗材成本,在经济形势比较严峻的今天,对我们的药企或是CRO企业都是个不错的选择。
